Enfermedades de transmisión genética
Fibrosis Quística
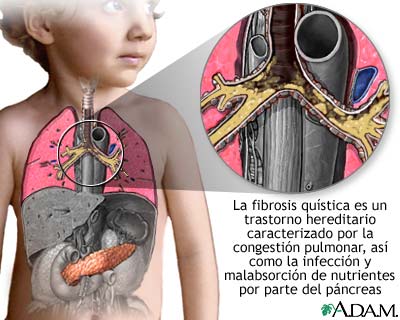
La fibrosis quística es una enfermedad hereditaria frecuente en la raza blanca que aparece en uno de cada 2500-4000 nacimientos. Consiste en una alteración genética en la que existe una mutación de un gen normal dando lugar al gen de la fibrosis quística (FQ). Se caracteriza por una disfunción de las glándulas exócrinas del organismo, por lo que también es llamada “la enfermedad de los besos salados”.
Aproximadamente 1 de cada 20 o 25 personas son portadores en la población general.
Si bien todos los grupos raciales pueden verse afectados por esta enfermedad, es más común en las personas de origen caucásico.
Raza blanca: 1 de cada 2.500 nacimientos.
Raza negra: 1 de cada 17.000 nacimientos.
Raza amarilla: 1 de cada 90.000 nacimientos.
Incidencia:
1. Se calcula 1 FQ sobre 2000 nacimientos en el mundo.
2. En la raza blanca, 1 de cada 20 personas es portadora sana de FQ, teniendo una mutación en el cromosoma 7.
“Besos salados”
La fibrosis quística se caracteriza por una disfunción de las glándulas exócrinas del organismo: sudoríparas, bronquiales, hepáticas, salivales, pancreáticas e intestinales, por lo que también es llamada “la enfermedad de los besos salados”. Los niños parecen sudar mucho y al besarlos, el sabor del sudor es muy salado.
Esta enfermedad es causada por una proteína anormal que no permite el ingreso y salida normales del cloruro (que junto con el sodio forman la sal) de ciertas células, incluidas las que revisten los pulmones y el páncreas. En consecuencia, estas células producen una secreción mucosa espesa y pegajosa y otras secreciones. La mucosidad obstruye los pulmones y causa problemas de respiración. Las personas afectadas también suelen tener infecciones en los pulmones, que terminan por dañarlos y contribuyen a una muerte prematura. Además, los líquidos digestivos espesos producidos por el páncreas no pueden llegar al intestino delgado, que los necesita para digerir los alimentos.
Afecta principalmente a la respiración y a la digestión. El resultado es desnutrición, falta de crecimiento y, finalmente, daño pulmonar permanente. Una enfermedad de tipo pulmonar suele ser la causa de muerte de la mayoría de los pacientes con FQ.
Los avances logrados en el tratamiento médico continúan mejorando las perspectivas para los niños y adultos que la padecen. Sin embargo, no existe aún una cura.
Antecedentes históricos
El 16 de enero de 1595, el famoso profesor de anatomía y botánica de Jeiden, Holanda, Peter Paaw, realizó la autopsia de una niña fallecida de 11 años que estaba muy delgada debido a una fiebre héctica y tenía pericarditis (inflamación de la pared exterior del corazón), una patología que en la moderna medicina se sabe que aparece en ciertos casos de FQ. Luego de la autopsia, el doctor anotó lo siguiente: “...se suponía que la niña estaba hechizada ... la niña estaba muy flaca ... el páncreas estaba abultado, cirroso y de color blanco brillante...”.
Esta curiosa historia nativa de Alemania tiene su par en un libro de medicina editado en 1606 y escrito por el profesor español Alonso, donde se puede leer el siguiente párrafo: “...una señora honorable dice que conoce a la gente embrujada, si al rascarles la frente, uno nota después un sabor salado en los dedos...”.
El segundo caso documentado de FQ tuvo lugar en Polonia, en 1673 y el tercero nuevamente en Holanda, cuatro años más tarde.
En un pequeño libro titulado “Observations Medicae Rariores”, publicado en 1677 por Gerarduis Blasius, director del Hospital de Amsterdam, escribe que realizó una autopsia de un niño fallecido a la edad de 9 años por una atrofia en el páncreas, el cual se encontraba cisrrócico (de consistencia fibrosa dura).
En los comienzos del siglo XV se suponía que los niños que de muy pequeños sufrían serios trastornos de nutrición y que en su frente tenían un excesivo sabor salado, se encontraban embrujados por la magia de duendes o de elfos.
Otras antiguas historias, similares a las anteriores, donde el exceso de sal en la frente de los niños era irremediablemente síntoma de hechizo, encantos, magia, posesión demoníaca, etc, se encontraron en otros tantos pueblos de Europa: Rusia, Checoslovaquia, Hungría, entre otros.
La patóloga norteamericana Dorothy Andersen, en 1938 fue la primera persona que utilizó el término “fibrosis quística del páncreas”, mientras que el doctor S. Farber, fue el primero en llamarla “mucoviscidosis”.
Síntomas
Los síntomas de la fibrosis quística pueden variar entre los niños. Un niño que nace con FQ suele presentar síntomas durante su primer año de vida. Sin embargo, a veces las señales no aparecen hasta 10 años después o más. Los recién nacidos y los niños pueden presentar diarrea persistente o gran cantidad de heces de olor desagradable o grasosas. Pueden llegar a tener también problemas pulmonares, pulmonía, tos crónica con mucosidad espesa y crecimiento retardado.
Diagnóstico
El análisis más común para diagnosticar la fibrosis quística es el análisis de sudor, el cual mide la cantidad de sal en las glándulas sudoríparas. Los pacientes con FQ tienen una alta cantidad de sal en sudor. En el caso de los recién nacidos, este examen no es el más apropiado, pues no transpiran tanto como los adultos; se les practica el análisis tripsinógeno inmunorreactivo (examen de reacción inmune a la tripsina). Los resultados positivos deben ser confirmados con un análisis de sudor, entre otros.
Algunos otros análisis que pueden ayudar en el diagnóstico de FQ incluyen radiografías de pecho, análisis de función pulmonar y cultivos de esputo (flema o mucosidad presente en los pulmones).
Los análisis de heces pueden identificar las anormalidades digestivas típicas de FQ.
Diagnóstico preimplantacional
Existen parejas en las que el riesgo de transmisión de una anomalía genética es tan elevado que su historial reproductivo incluye, generalmente, el nacimiento de un primer hijo afectado y a continuación una serie interminable de abortos espontáneos o provocados. Típicamente se trata de parejas portadoras de una enfermedad genética con herencia mendeliana y con riesgo de trasmisión del 25 al 50% (entre las que se incluye la FQ), o de parejas en las que uno de los progenitores (ocasionalmente ambos) es portador heterocigoto de una organización cromosómica estructural, en cuyo caso el riesgo de la transmisión cromosómica puede oscilar entre un 15 y un 90%. Para evitar el problema de estas parejas se han desarrollado las técnicas de diagnóstico preimplantacional (DPI), el cual permite la caracterización genética de los embriones previa a su implantación en el útero materno.
El DPI implica, por cuestiones técnicas y legales, el sometimiento de la pareja a técnicas de reproducción asistida (fecundación in vitro ICSI), aunque no presenten problemas de infertilidad asociados. Los embriones obtenidos se cultivan in vitro durante 3 días hasta el estadio de 3-8 células, momento en el cual se realiza una biopsia consistente en retirar una o dos células (blastómeros) las cuales serán analizadas genéticamente para deducir así las características genéticas del embrión previamente a su transferencia.
En el caso de la FQ, el análisis genético se realiza por amplificación específica de alelos mediante la técnica de reacción en cadena de la polimerasa (PCR), para determinar si el embrión es sano, portador o afecto de la enfermedad. En la actualidad se dispone de la información y los cebadores necesarios para detectar las variantes más frecuentes de la FQ entre la población. Los principales problemas que presenta esta técnica son los derivados de la amplificación específica de cantidades muy pequeñas de DNA, provenientes de un par de células como máximo.
Una vez obtenido el diagnóstico, los embriones sanos son transferidos.
El establecimiento de un programa de DPI está ligado estrechamente con un centro que realice la FIV, el cual debe disponer de las técnicas de manipulación embrionaria para la obtención de biopsias. Por otro lado, dicho equipo debe estar en contacto con un centro donde se puedan realizar técnicas de caracterización genética de las biopsias que hemos mencionado (PCR) puestas a punto para una coincidencia geográfica.
Ya en 1996 había descriptas más de 400 parejas que habían optado por este método diagnóstico, con una tasa global de embarazo de alrededor del 25 %, lo que se traduce en 89 niños nacidos sanos. 51 de estas parejas eran portadoras de FQ, de las cuales habían nacido 9 niños sanos.
Metabolismo de ácidos grasos
La descripción por primera vez de esta deficiencia en enfermos de FQ puede causar un impacto enorme, ya que una terapia basada en ácido docosahexaenoico (DHA) podría tener consecuencias beneficiosas tanto para niños como para adultos. No obstante, este tratamiento tendría que validarse a través de los ensayos clínicos oportunos
La fibrosis quística presenta un defecto específico en el metabolismo de los ácidos grasos, concretamente del DHA. Los ensayos realizados en modelo animal han confirmado este hallazgo, así como la posibilidad de aplicar una terapia con DHA en dosis concretas. Aunque son necesarios ensayos clínicos más avanzados, se sospecha que el beneficio puede extrapolarse a los pacientes con FQ.
Los pacientes con fibrosis quística presentan un defecto específico en el metabolismo de los ácidos grasos, concretamente de DHA, según los datos de un estudio que hoy publica The New England Journal of Medicine.
Este estudio pone de manifiesto que “a pesar de que el equilibrio de los ácidos grasos mejora la FQ, las altas dosis de DHA eran excepcionales en el modelo animal. Los suplementos y las altas dosis no parecen aportar más beneficios clínicos”.
La conclusión principal de la nueva investigación alude a que en los tejidos que expresan mutaciones en el gen regulador de la conductancia transmembranosa en la FQ (CFTR) existen alteraciones de los ácidos grasos similares a las de los ratones knockout para el gen de la FQ. En un estudio previo publicado en 1999 en Proceedings of the National Academy of Sciences, se demostraba que en los tejidos afectados de ratones knockout para el gen de la FQ aumenta la concentración de ácido araquidónico (AA) y disminuye la de DHA.
Este balance entre ácidos grasos podría predisponer a la inflamación. El hallazgo puede explicar por qué existe una excesiva respuesta inflamatoria en los pacientes con FQ. Es indicativo que los datos sobre la acción del omega-3 vayan en esta dirección, ya que incrementan los niveles de DHA y reducen los del araquidónico, lo cual reduce la inflamación.
En ensayos anteriores demostraban la existencia de este defecto bioquímico en pulmón, páncreas e intestino afectados por la enfermedad en modelo animal. El trabajo consistía en la administración oral de DHA, y se comprobó que se corregía la patología de los órganos afectados y que los ratones enfermos, pasivos hasta ese momento, normalizaban su actividad.
La nueva investigación se ha centrado en confirmar si este mismo defecto bioquímico se encuentra en los tejidos dañados por la FQ en humanos. Para ello, los investigadores analizaron los ácidos grasos en muestras de biopsias rectales y nasales, raspados epiteliales nasales y plasma en 38 sujetos con FQ y compararon los resultados con los de 13 heterocigotos obligados, 24 controles sanos, 11 pacientes con enfermedad inflamatoria intestinal, 9 con infecciones de las vías respiratorias altas y 16 personas con asma.
Por razones obvias, no podían hacerse biopsias de páncreas o intestino, así que los investigadores recurrieron a las mucosas rectal y nasal que también están afectadas por esta patología. El resultado: encontraron el mismo defecto descripto en los ratones knockout.
Las conclusiones del ensayo señalan que la relación entre el ácido araquidónico y el docosahexaenoico estaba aumentado en las muestras de biopsia de mucosa y submucosa nasal (p<0,001) y en las muestras de biopsia rectal (p=0,009) de los sujetos con FQ y suficiencia pancreática y de sujetos con FQ e insuficiencia pancreática, en comparación con los valores de los sujetos control sanos.
En el tejido nasal, el cambio reflejaba un aumento de la concentración de AA y una disminución de DHA. En las células de la mucosa nasal, la relación entre AA y DHA estaba aumentada en los sujetos con FQ (p<0,001) en comparación con los controles sanos, con valores intermedios entre estos dos grupos en los heterocigotos obligados (p<0,001).
La relación no estaba aumentada en los sujetos con enfermedad inflamatoria intestinal. Los sujetos con asma o con infección de las vías respiratorias altas presentaron valores intermedios entre los de las personas con FQ y los controles sanos. Aún no es posible determinar si una terapia basada en DHA similar a la utilizada en el modelo animal funcionaría en humanos.
Esta terapia podría ser una solución en pacientes, niños y adultos con FQ, aunque en último extremo tendría que utilizarse con personas en las que la enfermedad pulmonar no estuviese muy avanzada.
De todas formas, los expertos indican que habría que determinar cuál es el mejor momento para iniciar la administración de DHA, y aclarar si lo más conveniente es hacerlo durante el embarazo o en los primeros meses de vida.
Si se hace durante el embarazo, probablemente el niño tendría más posibilidades de tener el intestino y el páncreas normales, lo que puede prevenir la FQ. Lo que parece más lógico es no superar los doce meses de vida porque se sabe que, a partir de esa edad, el páncreas está irreversiblemente afectado. El efecto antiinflamatorio pulmonar de los 17S-docosatrienes y 17R-resolvins, metabolitos derivados del DHA, frenaría la evolución pulmonar.
Nutrición
La malnutrición con retraso en el crecimiento y retraso en la pubertad ha sido considerada durante mucho tiempo como un elemento constante de la fibrosis quística.
Esquemáticamente, se pueden distinguir dos fases nutricionales en la evolución de la fibrosis quística:
- Durante la primera fase, en el bebé o en el niño, la malnutrición proteico-energética es ante todo debida a la insuficiencia pancreática externa. Es eficazmente corregida mediante unas medidas dietéticas y el aporte de unas enzimas pancreáticas.
La ampliación del régimen lipídico se debe hacer preferiblemente hacia grasas ricas en ácidos grasos esenciales.
- Durante la segunda fase, que ocurre más o menos temprano según los casos, las infecciones de repetición, la bronconeumopatía obstructiva, y más tarde la hipoxia y la anorexia se convierten en factores esenciales de malnutrición, la cual agrava a su vez la función respiratoria y facilita las sobre infecciones. A este nivel, la corrección de la malnutrición se vuelve más difícil, y necesita métodos más activos.
No obstante, la asistencia nutricional debe ser lo menos agresiva posible, privilegiando o favoreciendo siempre la alimentación oral normal, controlada por encuestas dietéticas. Es sólo en casos de fracaso que se debe poner en marcha el aporte de unos suplementos con productos dietéticos industriales. Si esta medida es ineficaz, una técnica de nutrición enteral, preferentemente nocturna por gastrostomia (gracias a las actuales cápsulas de gastrostomia), es necesaria. El recurso a los métodos de nutrición por vía intravenosa puede ser útil como complemento de las curas antibióticas intravenosas, cuando aquellas son necesarias, y de manera más continua, en pacientes muy desnutridos en espera de transplante.
Finalmente, es necesario insistir sobre los riesgos de deficiencias específicas que deben ser prevenidas y corregidas: carencias en ácidos grasos esenciales, en vitaminas liposolubles (A, D, E, K), en sales minerales (en particular en cloruro de sodio, sobre todo en verano), o en oligoelementos, particularmente hierro, zinc y selenio.
Calidad de vida
Si bien actualmente no existe una cura para el paciente con fibrosis quística, pueden reducirse los síntomas y disminuir el progreso de la enfermedad para elevar la calidad de vida del paciente.
Un objetivo importante del tratamiento de la FQ es reducir la obstrucción de las vías respiratorias que suelen causar infecciones pulmonares crónicas. La terapia física de rehabilitación, ejercicios y medicamentos son la forma más común de reducir la cantidad de mucosidad que podría llegar a obstruir las vías respiratorias del paciente.
Para los casos avanzados, la cirugía de transplante pulmonar podría llegar a ser una opción.
Los problemas digestivos son menos serios que los pulmonares, y pueden tratarse con mayor facilidad. Los especialistas recomiendan una dieta bien equilibrada, alta en contenido calórico y rica en proteínas y enzimas pancreáticas y consumir vitaminas A, D, E y K a los efectos de facilitar la digestión.
Es importante que las personas con FQ y sus familiares trabajen en estrecho vínculo con sus médicos y profesionales de la salud para desarrollar técnicas de cuidados personales que les permitan mejorar su calidad de vida.
Fuentes:
- Asociación Argentina de lucha contra la Enfermedad Fibroquística del Páncreas.
- http://www.nlm.nih.gov/
Otras notas
Este trabajo surge del encuentro azaroso -si es que las casualidades existen- entre una docente y una psicomotricista, al que se sumó la búsqueda interesada. Esos encuentros compartidos durante cinco años fueron, en un principio, la anécdota y el...

El Bradley Timepiece es un reloj pensado para personas no videntes y es tan innovador que ha sido nominado al Mejor Diseño del año por...
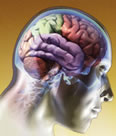
El cerebro contiene miles de millones de células que se interconectan para formar una compleja red de comunicación. Contiene diferentes tipos de células, siendo las más importantes las neuronas; su organización en el cerebro y la comunicación entre ellas


